 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!
 Thank you for choosing ACROBiosystems. Would you rate our product and service?
Thank you for choosing ACROBiosystems. Would you rate our product and service?  Thank you for choosing ACROBiosystems. Would you rate our product and service?
Thank you for choosing ACROBiosystems. Would you rate our product and service?
 Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!  Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!
> 細胞培養用の成長因子
細胞治療医薬品の開発者をサポートするために、ACROBiosystemsは免疫細胞、幹細胞、オルガノイドなど、様々な細胞in vitro培養に対応する高品質なサイトカインを幅広く開発しております。また、開発の各段階やアプリケーションのニーズに対応するため、Premium(Pre-GMP)、GMP準拠のサイトカインを提供しております。この3つのグレードは、いずれも同様の製造工程で製造されているため、グレード間の移行もシームレスに行うことができるため、研究開発を加速できます。
| Premium(Pre-GMP) Grade | GMP Grade | |
|---|---|---|
| アプリケーション | 研究開発、前臨床研究、臨床段階へのシームレスな移行 | 臨床段階の要件を満たし、各規制機関へのIND申請を強化するように設計されています。 |
| 品質基準 | ISO 9001 /ISO 13485 認証取得 | ISO 9001 /ISO 13485 認証取得(開発段階) GMP品質管理システム(製造段階) |
| 製造過程 | ISO認証取得工場 | GMP認証取得工場 |
| 一過性発現 ・安定発現細胞株 | 安定発現細胞株 (USPとChP による完全な検査) | |
| 動物由来成分不使用またはBSE/TSE不使用 | 動物由来成分不使用またはBSE/TSE不使用 | |
| 医薬品グレードの原材料 | 医薬品グレードの原材料 | |
| 二次無菌濾過 | 二次無菌濾過 | |
| クラスC+Aルーム、手動無菌充填(ISO5準拠) | 自動充填機を備えたクラスB+Aのクリーンルーム | |
| ウイルス除去のための追加工程が不要 | 2回のウイルス除去・不活性化工程を追加(ナノフィルトレーション+低pH) | |
| 品質管理 | 無菌性・マイコプラズマ試験 | 無菌性・マイコプラズマ試験 |
| エンドトキシンの制御と検出 | エンドトキシンの制御と検出 | |
| 検証済み機器・分析機器・分析方法 | 検証済み機器・分析機器・分析方法(監査証跡あり) | |
| 残留DNA/HCP検査 | 残留DNA/HCP検査 | |
| 限定的な外来性病原体検査 | 完全な外来病原体試験(ウイルス試験および動物の生体内安全性実験) | |
| ドキュメンテーション | 共通のレギュレーションに対応 | 包括的なレギュラトリーサポートファイル |
| DMFファイリング(一部の製品) | DMFファイリング(全製品) |
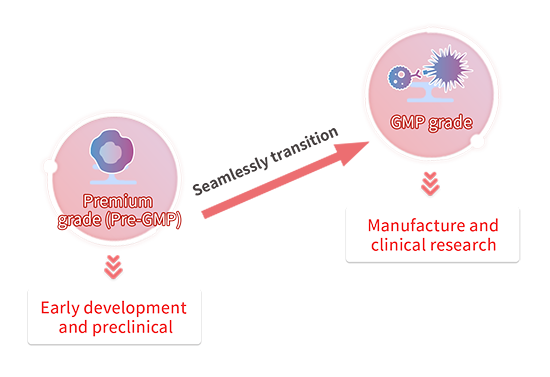
サイトカインは、細胞・遺伝子治療薬(CGT)の細胞培養に使用される重要な原材料です。通常、前臨床段階では、原料の安全性や品質が優先的に考慮されず、研究用グレードの原料が使用されます。しかし、CMCや臨床といった医薬品開発の後期段階に進むと、規制ガイドラインに準拠するために、原材料をGMP準拠のものに置き換えることが必要になります。この過渡期には、新しい原材料の再評価とバリデーションに多大な精力が費やされます。
前臨床開発から臨床段階への移行をシームレスにするために、GMP 製品に必要なファイルとともに、生物活性がほぼ同一であるグレードのサイトカインを提供されています。 CMCまたは臨床段階に入る際にGMP準拠の原材料にシームレスに移行し、再評価と検証実験の回数を最小限に抑えられるので、開発の初期段階でPremium(Pre-GMP)グレードの原材料を使用することをお勧めします。
![]() 無菌
無菌
![]() アニマルフリー
アニマルフリー
![]() 高純度≥95
高純度≥95
![]() セルベースアッセイで検証された高い生物活性
セルベースアッセイで検証された高い生物活性
![]() Premium(Pre-GMP)グレード、GMP準拠をラインアップ
Premium(Pre-GMP)グレード、GMP準拠をラインアップ
![]() 低エンドトキシン≦0.1EU/μg
低エンドトキシン≦0.1EU/μg
![]() キャリアフリー
キャリアフリー
![]() 自然のコンフォメーションと修飾に近い
自然のコンフォメーションと修飾に近い
![]() ロット間の一貫性が高い
ロット間の一貫性が高い
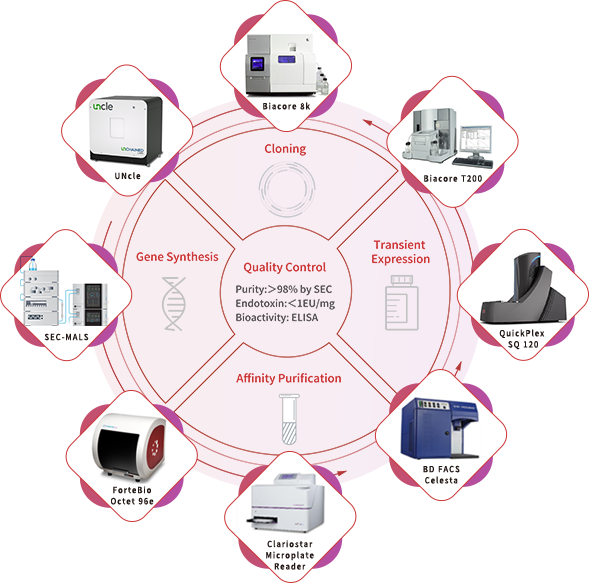
5,000 種類を超える組み換えタンパク質のポートフォリオと、それぞれに対応のタンパク質開発プラットフォームを備えた ACROBiosystems は、業界をリードし、組み換えタンパク質の開発において 10 年以上の経験を蓄積してきました。カスタマイズ GMP グレードタンパク質は、弊社のタンパク質プラットフォームで構造的に設計され、細胞療法薬の製造のために検証されています。ACROBiosystemsは、包括的な品質管理システムを実施し、 GMP ガイドラインに厳密に準拠するように注意を払い、開発プロセスをサポートできるような高品質の原材料を提供します。GMP準拠のカスタマイズタンパク質サービスは、お客様のニーズに基づいて、治療の成功率を最大化します。弊社のNon-GMP準拠タンパク質製品からGMP準拠への移行、または前臨床研究開発段階のNon-GMPグ準拠タンパク質開発から臨床GMP準拠のタンパク質生産までのワンストップ開発サービスを提供できます。
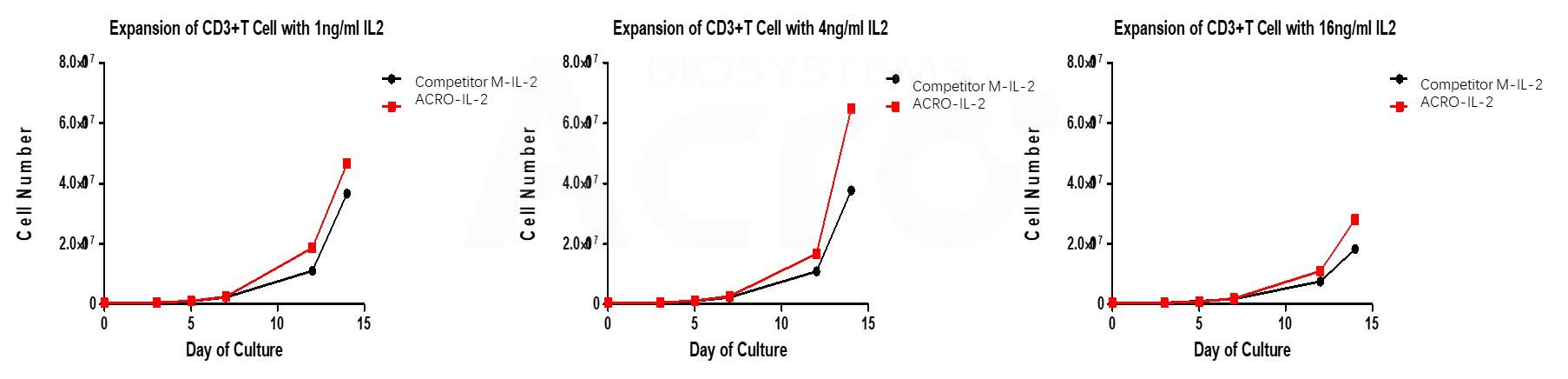
ACRO’s Human IL-2, premium grade (Cat. No.IL2-H5215) has higher bioactivity than that of other competitors when activates T cell with CD3/CD28 magnetic beads at different concentrations.
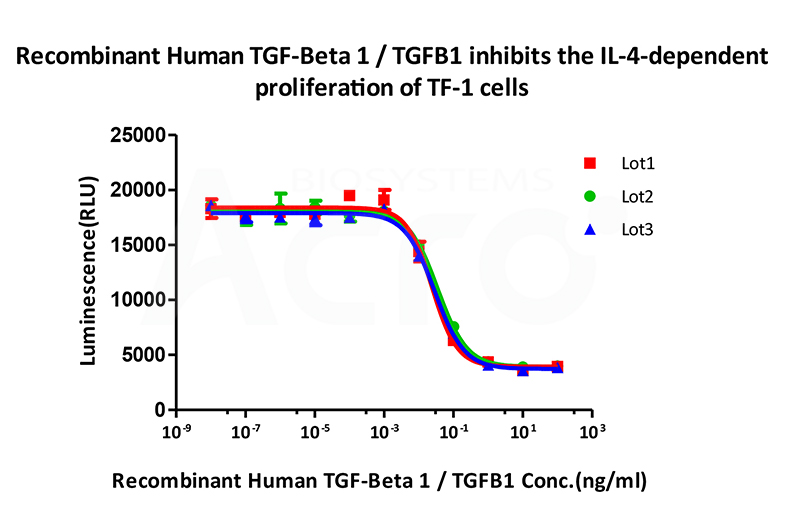
Bioactivity of three different lots of Recombinant Human TGF-Beta 1 TGFB1 (Cat. No. TG1-H4212) is verified by cell-based assay, and the result shows very high batch-to-batch consistency.
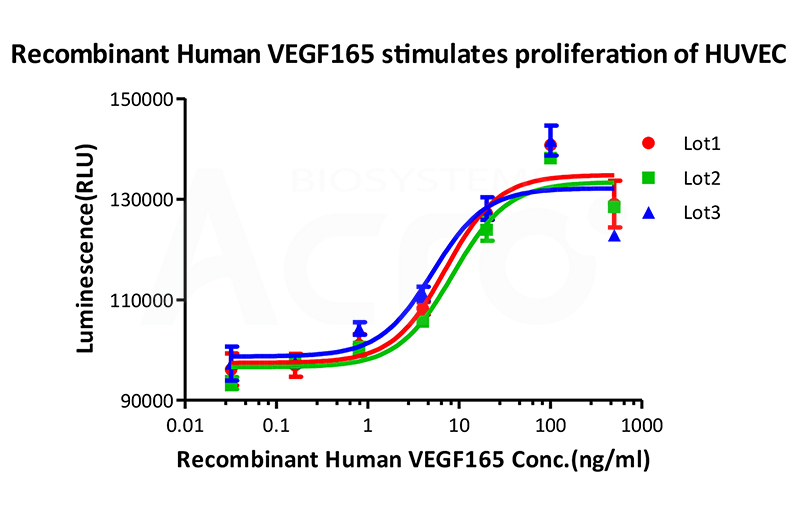
Bioactivity of three different lots of Recombinant Human VEGF165 (Cat. No. VE5-H4210) is verified by cell-based assay, and the result shows very high batch-to-batch consistency.
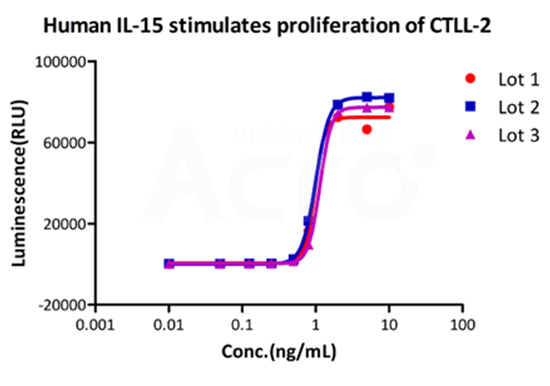
Recombinant Human IL-15 Protein (premium grade), designed for preclinical stage, has the same functional activity and performance as GMP Grade IL-15 (Cat. No.GMP-L15H13), which enables a seamless transition from preclinical development to clinical phases.
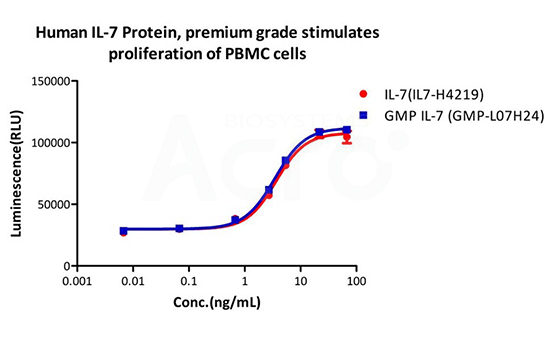
Human IL-7 Protein (premium grade) designed for preclinical stage, has the same functional activity and performance as GMP Grade IL-7 (Cat. No. GMP-L07H24), which enables a seamless transition from preclinical development to clinical phases.
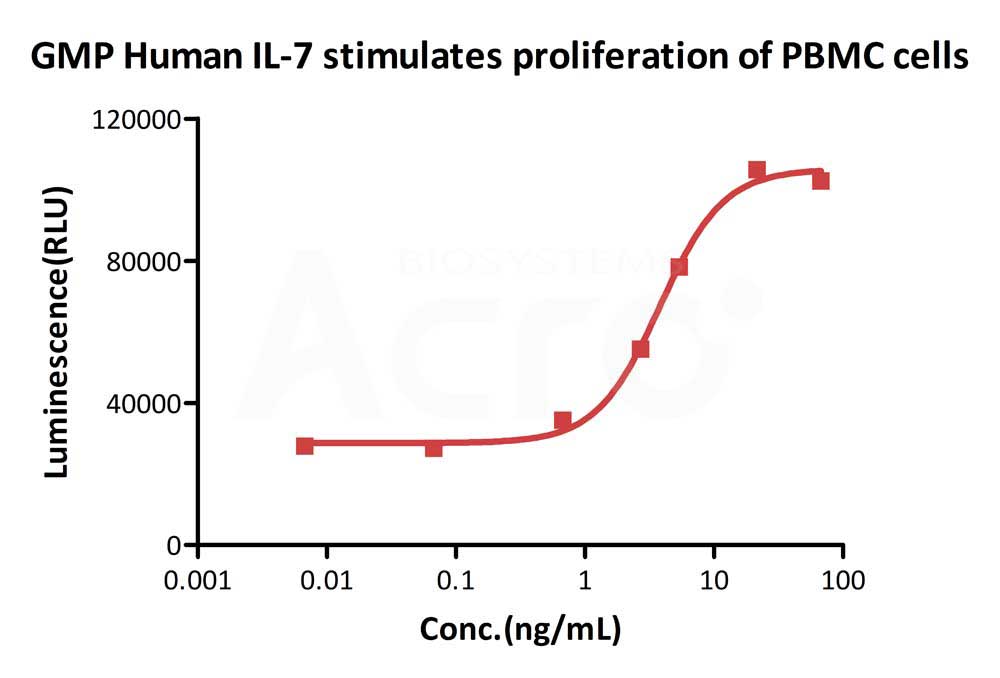
GMP Human IL-7 (Cat. No.GMP-L07H24) stimulates proliferation of PHA-P-activated human peripheral blood mononuclear cell (PBMC). The EC50 for this effect is 3.821 ng/mL, corresponding to a specific activity of > 1.0 ⅹ10^8 IU/mg, which is calibrated against human IL-7 WHO International Standard (NIBSC code: 90/530) (QC tested).
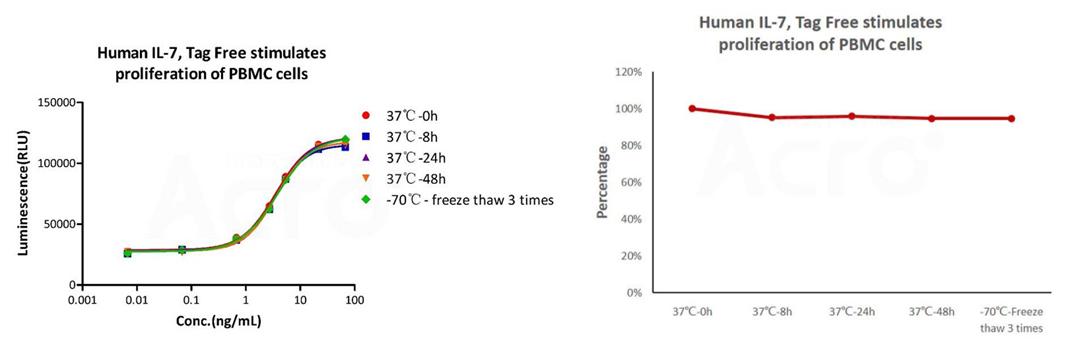
The cell-based assay shows that GMP Human IL-7 (Cat. No. GMP-L07H24) is stable at 37°C for 48 hours and after freezing and thawing 3 times.

Bioactivity of three different lots of GMP Human IL-15 (Cat. No.GMP-L15H13) verified by cell-based assay, and the result shows very high batch-to-batch consistency.
This web search service is supported by Google Inc.