

























 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!
 Thank you for choosing ACROBiosystems. Would you rate our product and service?
Thank you for choosing ACROBiosystems. Would you rate our product and service?  Thank you for choosing ACROBiosystems. Would you rate our product and service?
Thank you for choosing ACROBiosystems. Would you rate our product and service?
 Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!  Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!
> PFF体(Preformed Fibril)--神経変性疾患モデルへの新しいアプローチ
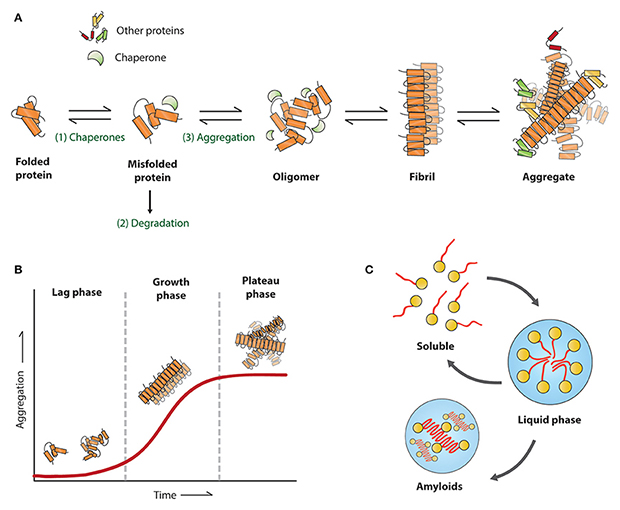
タンパク質の凝集は、アルツハイマー病 (AD)、パーキンソン病 (PD)、筋萎縮性側索硬化症 (ALS)、ハンチントン病 (HD) などの神経変性疾患の主要な病理学的特徴です。 病理学的条件下では、タウ、アミロイドベータ、アルファシヌクレイン、TDP-43、ハンチンチン、およびその他のタンパク質が、オリゴマーや前線維集合体から高度に秩序化された凝集体に至るまで、さまざまな望ましくない構造に統合されます。 これらのフィブリ構造は「活性化」であり、伸長のためにモノマーを急速に動員するため、フィブリ構造はタンパク質凝集の急速な成長段階を表しています。 さらに、これらのフィブリは、「seed」として機能する可能性のある短い断片にランダムに分割され、他の細胞に伝達され、モノマーを独立して動員して新しいフィブリを形成します。 PFF体(Preformed Fibril)は、in vitro で形成されたアクティブなフィブリルであり、この「seeding」の活性を持ち、可溶性の内因性病理学的タンパク質を継続的に動員して凝集体を形成し、最終的に神経変性病理を誘発します。
信頼性の高い疾患モデルの確立は、病理学的メカニズムの発見、治療介入の有効性の評価や薬剤候補の安全性の評価に不可欠です。 従来の疾患モデリング アプローチと比較して、PFF によって誘発される病理は、遺伝子編集、化学的または物理的損傷に依存せず、自然に発生する病理学的状態をよりよく模倣できます。 したがって、PFFは、神経変性疾患をモデル化するための新しいアプローチです。.
PFF体は、37℃でインキュベートして振とうするか、ヘパリン誘導によって単量体から生成します。 実験を成功させるには、品質管理と正確な初期準備が重要です。 PFF体の誘導を成功させる要素は、高純度、高濃度、正しいコンフォメーションを備えた高品質の単量体を使用することです。 一方、PFF体の応用は細胞実験や動物実験であるため、エンドトキシンの制御も重要です。 さらに、PFF を使用する前に、超音波を介して PFF の長さを 50 nm 以下にして、PFF の動員活性を確保し、PFF のエンドサイトーシスを促進する必要があります。
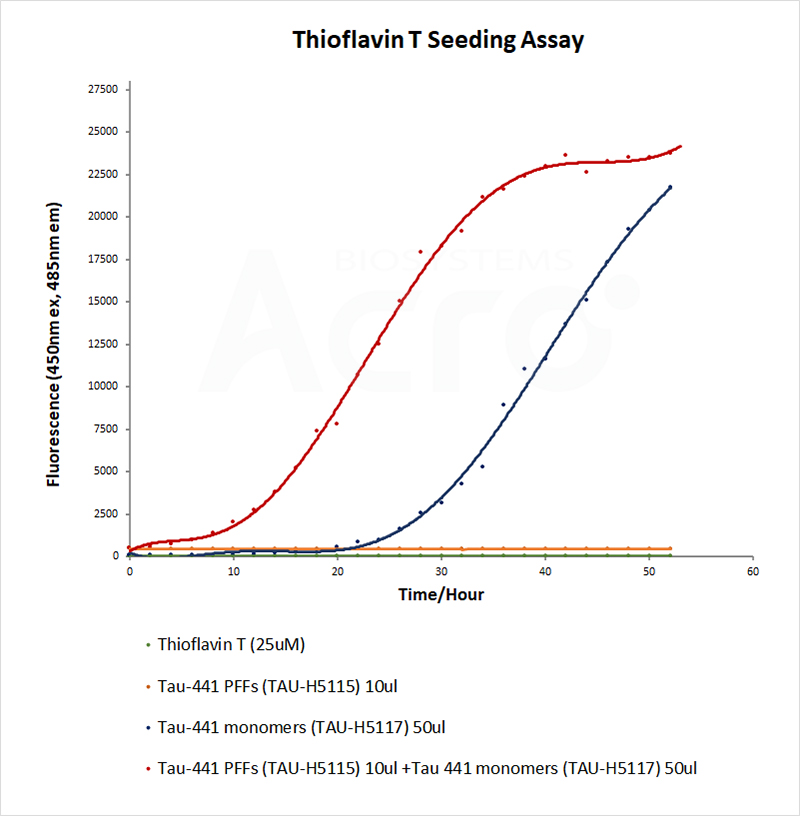
PFF の形態と活性は、それぞれ電子顕微鏡とチオフラビン T (ThT) 蛍光アッセイによって検証できます。 正常に誘導された PFF は、電子顕微鏡下でフィブリル構造を示します。 ThT アッセイは、β シート構造を検出するための一般的なアッセイです。 PFFは、モノマーを動員するにつれてβシート構造をどんどん獲得し、ThTがβシート構造に結合すると、蛍光値が上昇するため、PFFの活性を反映することができます。
Aneuroは 、ACROBiosystemsが神経科学分野における特化したブランドです。Tau-441 PFF、α-シヌクレインPFF、アミロイドβPFF、TDP-43 PFF、SOD-1 PFFを提供し、信頼性の高い神経変性モデルの確立を支援・加速させます。
| Molecule | Cat. No. | Product Description | Monomer Source | Expression System | Preorder/Order |
|---|---|---|---|---|---|
| Tau | TAU-H5115 | Human Tau-441/2N4R Pre-formed Fibrils Protein, Tag Free | TAU-H5117 | E.coli | |
| TAU-H5116 | Human Tau-441 K18 Pre-formed Fibrils Protein, Tag Free | NA | E.coli | ||
| TAU-H5113 | Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein, Tag Free | TAU-H5118 | E.coli | ||
| Alpha-Synuclein | ALN-H5114 | Human Alpha-Synuclein (A53T) Pre-formed Fibrils Protein, Tag Free | ALN-H5116 | E.coli | |
| ALN-H5115 | Human Alpha-Synuclein Pre-formed Fibrils Protein, Tag Free | ALN-H5214 | E.coli |
Meanwhile, alpha-synuclein PFFs,Amyloid beta PFFs,TDP-43 PFFs,SOD-1 PFFs are under development.
お問い合わせ
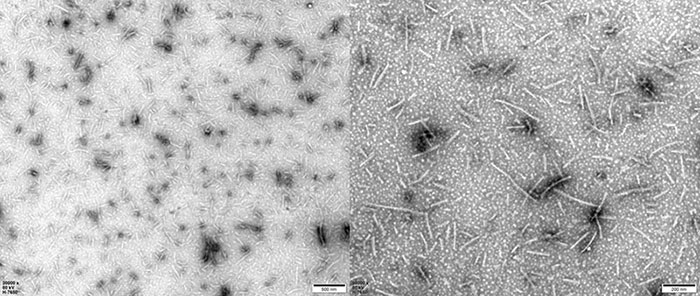
TEM of Human Tau-441/2N4R Pre-formed Fibrils Protein (Cat. No. TAU-H5115).
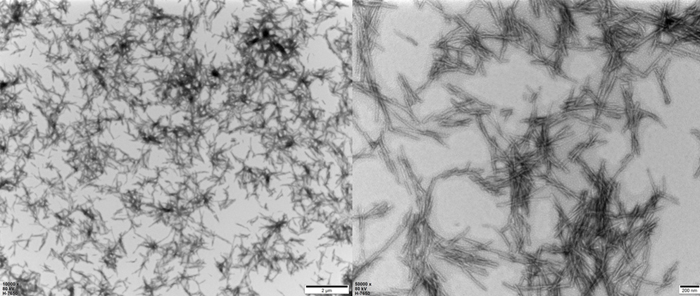
TEM of Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein (Cat. No. TAU-H5113).
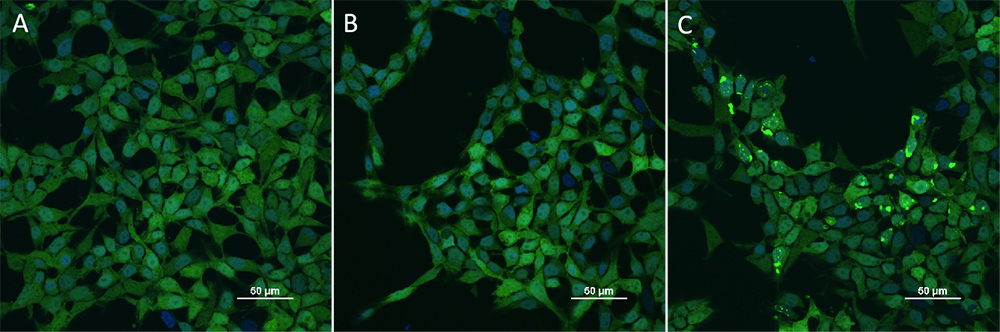
HEK293/Human Tau(GFP) Stable Cell Line were transduced with Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) (Cat. No. TAU-H5115) and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) (Cat. No. TAU-H5117) respectively. The fluorescence of GFP-Tau (Green) and DAPI (Blue) were detected by confocal microscope. A. Lipo2000 transduction. B. Lipo2000 and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) transduction. C. Lipo2000 and Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) transduction. Scale bars, 50 μm.
1. Stroo E, Koopman M, Nollen EA, Mata-Cabana A. Cellular Regulation of Amyloid Formation in Aging and Disease. Front Neurosci (2017). doi: 10.3389/fnins.2017.00064. PMID: 28261044; PMCID: PMC5306383.
2. Guo JL, Lee VM. Seeding of normal Tau by pathological Tau conformers drives pathogenesis of Alzheimer-like tangles. J Biol Chem (2011). doi: 10.1074/jbc.M110.209296. Epub 2011 Mar 3. PMID: 21372138; PMCID: PMC3083182.
This web search service is supported by Google Inc.